Practica de laboratorio
Reconocimiento de algunos grupos funcionales orgánicos.
Logro:
1) observar algunas propiedades fricas y químicas de compuestos orgánicos
2) reconocer experimentalmente aldeidos- cetonas- hidrocarburos- alcoholes- ácidos carboxílicos.
1. LA UREA


Estructura de la Urea

La urea es un compuesto químico cristalino e incoloro; de fórmula CO(NH2)2. Se encuentra abundantemente en la orina y en la materia fecal. Es el principal producto terminal del metabolismo de las proteínas en el humano y en los demás mamíferos.
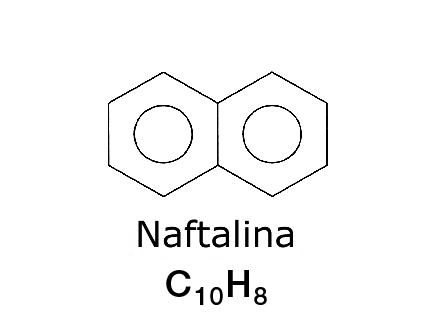
2. LA NAFTALINA

Luego cogimos un tuvo de ensayo con acetileno es de color café y un olor desagradable
después le echamos unas gotas de agua y vimos que se calentaba esto quiere decir que es una combustión exotermica y el olor del gas es el acetileno.
Después hicimos una practica para determinar si hay azúcar para esto utilizamos el reactivo de fehling a y b , Tomamos un tubo de ensayo fehling a y b en cantidades iguales y lo echamos en un tubo de ensayo se volvió de color azul después le añadimos una azúcar que fue aldosas y cetosas de ahí la pusimos a calentar al baño de maría se dejo por 5 minutos y se torno de color naranjado pálido lo que nos lleva a la conclucion que si hubo presencia de azúcar.
Lo ultimo que hicimos fue el espejo de plata en este utilizamos formol,amoniaco ,NAOH y se hierve y queda con color negro al echarle el nitrato de plata queda de color metal plateado
.
Consultas:
Formula de la Sacarosa:
C12H22O11

Formula de la lactosa ( azucar) :
C12H22O11·H2O

Como se clasifican los azucares:
.jpg)
El ácido benzoico para que se utiliza ?: Los benzoatos se derivan del ácido benzoico y se utilizan más comúnmente como conservantes alimentarios que el ácido. Algunas personas desarrollan síntomas similares a los de una alergia cuando están expuestas al benzoato sódico. Cuando el producto químico reacciona con la vitamina C (ácido ascórbico) en las bebidas bajo ciertas condiciones, se puede producir benceno. El benceno es un carcinógeno. Un carcinógeno es una sustancia capaz de causar cáncer.
El reactivo de Lucas: El reactivo de Lucas es una solución de ZnCl2 disuelto en HCl concentrado que se usa en química orgánica. Esta disolución es usada para clasificar alcoholes de bajo peso molecular. La reacción es una sustitución en el cual el cloruro reemplaza el grupo hidroxilo. Un ensayo positivo es indicado por un cambio desde una solución limpia y sin color a una turbidez, que se trata de la formación de un cloroalcano.1
Lucas test.png
Cuando se agrega el reactivo de Lucas al alcohol, el H+ del HCl protonará el grupo -OH del alcohol, tal que el grupo saliente H2O, siendo un nucleófilo más débil que el OH-, pueda ser sustituido por el nucleófilo Cl-.
El reactivo de Lucas ofrece un medio polar en el que el mecanismo SN1 está favorecido. En la sustitución nucleofílica unimolecular, la velocidad de reacción es más rápida cuando el carbocatión intermediario está más estabilizado por un mayor número de grupos alquilo (R-) donantes de electrones, unidos al átomo de carbono cargado positivamente. Los alcoholes terciarios reaccionan inmediatamente con el reactivo de Lucas para producir turbidez, mientras que los alcoholes secundarios lo hacen en cinco minutos. Los alcoholes primarios no reaccionan significativamente con el reactivo de Lucas a temperatura ambiente.
De ahí que, el tiempo que toma la turbidez en aparecer es una medida de la reactividad del tipo de alcohol con el reactivo de Lucas, y esto es utilizado para diferenciar entre las tres clases de alcoholes:
no hay reacción visible: alcohol primario
la solución se turbia en 3-5 minutos: alcohol secundario
la solución se vuelve turbia inmediatamente, y/o las fases se separan: alcohol terciario, bencílico o alílico
La prueba es llevada a cabo generalmente a temperatura ambiente.
después le echamos unas gotas de agua y vimos que se calentaba esto quiere decir que es una combustión exotermica y el olor del gas es el acetileno.
Después hicimos una practica para determinar si hay azúcar para esto utilizamos el reactivo de fehling a y b , Tomamos un tubo de ensayo fehling a y b en cantidades iguales y lo echamos en un tubo de ensayo se volvió de color azul después le añadimos una azúcar que fue aldosas y cetosas de ahí la pusimos a calentar al baño de maría se dejo por 5 minutos y se torno de color naranjado pálido lo que nos lleva a la conclucion que si hubo presencia de azúcar.
Lo ultimo que hicimos fue el espejo de plata en este utilizamos formol,amoniaco ,NAOH y se hierve y queda con color negro al echarle el nitrato de plata queda de color metal plateado
.
Consultas:
Formula de la Sacarosa:
C12H22O11
Formula de la lactosa ( azucar) :
C12H22O11·H2O
Como se clasifican los azucares:
.jpg)
El ácido benzoico para que se utiliza ?: Los benzoatos se derivan del ácido benzoico y se utilizan más comúnmente como conservantes alimentarios que el ácido. Algunas personas desarrollan síntomas similares a los de una alergia cuando están expuestas al benzoato sódico. Cuando el producto químico reacciona con la vitamina C (ácido ascórbico) en las bebidas bajo ciertas condiciones, se puede producir benceno. El benceno es un carcinógeno. Un carcinógeno es una sustancia capaz de causar cáncer.
El reactivo de Lucas: El reactivo de Lucas es una solución de ZnCl2 disuelto en HCl concentrado que se usa en química orgánica. Esta disolución es usada para clasificar alcoholes de bajo peso molecular. La reacción es una sustitución en el cual el cloruro reemplaza el grupo hidroxilo. Un ensayo positivo es indicado por un cambio desde una solución limpia y sin color a una turbidez, que se trata de la formación de un cloroalcano.1
Lucas test.png
Cuando se agrega el reactivo de Lucas al alcohol, el H+ del HCl protonará el grupo -OH del alcohol, tal que el grupo saliente H2O, siendo un nucleófilo más débil que el OH-, pueda ser sustituido por el nucleófilo Cl-.
El reactivo de Lucas ofrece un medio polar en el que el mecanismo SN1 está favorecido. En la sustitución nucleofílica unimolecular, la velocidad de reacción es más rápida cuando el carbocatión intermediario está más estabilizado por un mayor número de grupos alquilo (R-) donantes de electrones, unidos al átomo de carbono cargado positivamente. Los alcoholes terciarios reaccionan inmediatamente con el reactivo de Lucas para producir turbidez, mientras que los alcoholes secundarios lo hacen en cinco minutos. Los alcoholes primarios no reaccionan significativamente con el reactivo de Lucas a temperatura ambiente.
De ahí que, el tiempo que toma la turbidez en aparecer es una medida de la reactividad del tipo de alcohol con el reactivo de Lucas, y esto es utilizado para diferenciar entre las tres clases de alcoholes:
no hay reacción visible: alcohol primario
la solución se turbia en 3-5 minutos: alcohol secundario
la solución se vuelve turbia inmediatamente, y/o las fases se separan: alcohol terciario, bencílico o alílico
La prueba es llevada a cabo generalmente a temperatura ambiente.




No hay comentarios:
Publicar un comentario