Oasis- Para vivir mas - Gonzalo Gallo
Reflexión: No tener le miedo a la muerte, somos seres vivos y debemos aceptar lo que pase o suceda.
!Dios es perfecto al decir y hacer sus cosas!
Confluencia de genalidades - Vangont'
Reflexión: Con solo una imagen que veamos podemos describir lo que refleja, las frases son el reflejo de lo que hacemos y lo que vivimos.
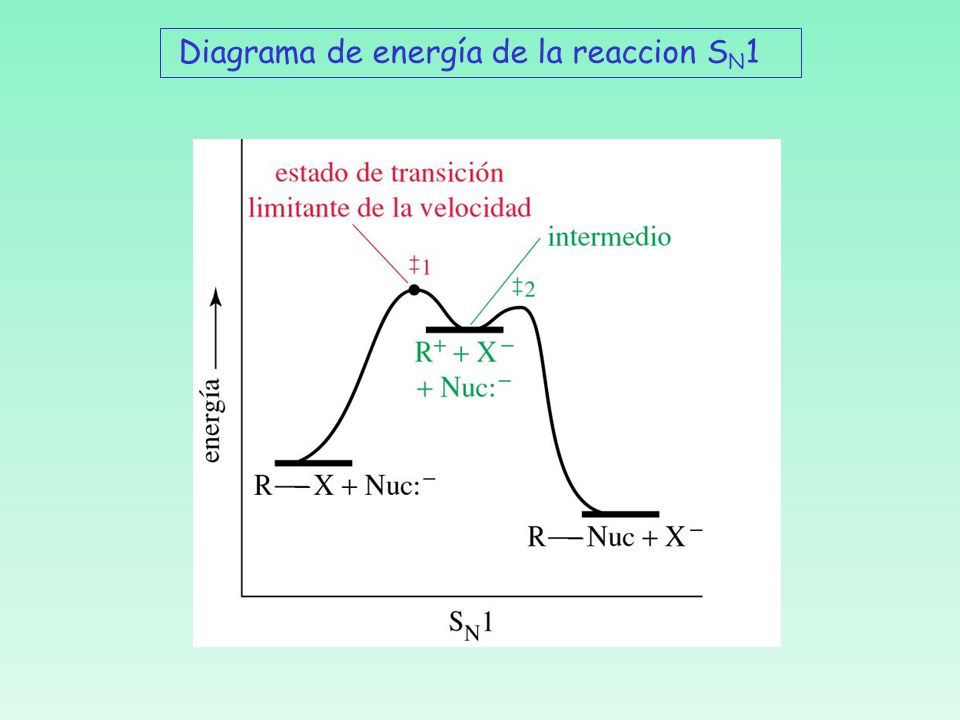
Representacion gráfica de una reacción orgánica.
Reacción de oxidación de los hidrocarburos.(combustión de H.C ): es la reacción mas importante de los H.C y dependiendo de la cantidadde oxigeno disponible se presentan tres tipos de reaccion.
- Reacción completa_ H.C + O2- CO2 + H2O + E
-Reacción incompleta_ H.C + O2- CO + H2O + E
-Reacción parcial _ H.C + O2 - C + H2O + E
(Alcano, alqueno y alquino)
ALCANO
La familia más sencilla de este grupo es la de los alcanos que se caracteriza por la formula general (CnH2n+2). Por su estructura los alcanos se denominan también hidrocarburos saturados.
En una molécula de alcano los únicos enlaces químicos existentes son los sencillos entre átomos de carbono y entre átomos de carbono e hidrogeno. Debido a la gran estabilidad de estos enlaces los alcanos son poco reactivos, por lo cual se los denomina también parafinas.
Los alcanos se obtienen principalmente del petróleo y del gas natural, donde se encuentran mezclados como productos de la descomposición anaeróbica de la materia viva.
Combustión
2 CnH2n+2 + 3 (n+1) O2flecha 2nCO2 + 2(n+2) H2O + Calor
ALQUENOS
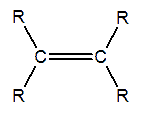
Un alqueno es un hidrocarburo con un doble enlace. Algunas veces a los alquenos también se los llama olefinas, nombre que procede de gas olefianta (gas formador de aceite), con el que se conocía antiguamente al etileno (CH2=CH2).
El doble enlace carbono-carbono es un grupo funcional bastante común en los productos naturales. Frecuentemente, el doble enlace se encuentra junto con otros grupos funcionales. Sin embargo, el doble enlace se encuentra junto con otros grupos funcionales y se encuentran a menudo en las plantas y en el petróleo. A continuación se dan dos interesante ejemplos de compuestos que se encuentran en la naturaleza y que contienen dobles enlaces carbono-carbono.
Alcanos
La familia más sencilla de este grupo es la de los alcanos que se caracteriza por la formula general (CnH2n+2). Por su estructura los alcanos se denominan también hidrocarburos saturados.
En una molécula de alcano los únicos enlaces químicos existentes son los sencillos entre átomos de carbono y entre átomos de carbono e hidrogeno. Debido a la gran estabilidad de estos enlaces los alcanos son poco reactivos, por lo cual se los denomina también parafinas.
Los alcanos se obtienen principalmente del petróleo y del gas natural, donde se encuentran mezclados como productos de la descomposición anaeróbica de la materia viva.
Combustión
2 CnH2n+2 + 3 (n+1) O2flecha 2nCO2 + 2(n+2) H2O + Calor
Combustión
El eteno arde con una llama amarillenta, índice de la presencia de una doble ligadura (esto indica la razón de la existencia de poco hidrógeno en comparación con la cantidad de carbono.).
H2-C=C-H2 + O2flechaCO2 + H2O
La ecuación anterior muestra una combustión completa, lo que generalmente no ocurre en el laboratorio. Se debe considerar entonces la posibilidad de la presencia de otros productos, según la siguiente ecuación:
H2-C=C-H2 + O2flechaCO2 + CO + C + H2O
ALQUINOS
Los alquinos, también llamados acetilenos, son hidrocarburos que contienen un triple enlace carbono-carbono. El propio etino (también llamado acetileno), HC≡CH, que es el alquino más simple, alguna vez fue ampliamente usado en la industria como materia prima para la elaboración de acetaldehído, ácido acético, cloruro de vinilo y otros productos en grandes cantidades, pero ahora son más comunes otros procesos más eficientes en los que se utiliza eteno como materia prima.
Combustión del etino
En la combustión de etino se observa una llama amarillenta y fuliginosa, con bordes oscuros y gran cantidad de material en suspensión desprendida durante la combustión.
La llama amarillenta se debe a la baja proporción de hidrógeno en la molécula (debido al triple enlace) frente a la cantidad de carbono en la misma.
H-C ≡ C-H + O2flechaCO2 + H2O
La ecuación anterior muestra una combustión completa, lo que generalmente no ocurre en la práctica corriente de laboratorio. Se debe tener, entonces, en cuenta la posibilidad de la presencia de monóxido de carbono y carbono nativo, según:
H-C ≡ C-H + O2flechaCO2 + CO + C + H2O.
VIDEOS DE COMBUSTION
No hay comentarios:
Publicar un comentario